Vero宿主細(xì)胞蛋白(HCP)殘留檢測高風(fēng)險(xiǎn)蛋白
來源:
發(fā)布時(shí)間:2025-10-31
在宿主細(xì)胞蛋白(HCP)殘留檢測的分析方法里,ELISA法應(yīng)用較多,也是QC日常放行檢測的主要方式。該方法操作相對簡便、檢測精度較好,便于設(shè)定控制范圍與制定技術(shù)規(guī)范,適用于產(chǎn)品開發(fā)及過程控制;不過,ELISA檢測依賴抗原與抗體的特異性結(jié)合,因此以生物制品中HCP為免疫原制備的抗體質(zhì)量,對檢測結(jié)果影響極大。無論是市售ELISA試劑盒,還是實(shí)驗(yàn)室自制的多克隆抗體,若抗體的特異性與適用性不足,都可能導(dǎo)致HCP漏檢,進(jìn)而給生物制品質(zhì)量安全埋下隱患。另外,ELISA檢測HCP時(shí)采用多克隆抗體,無法針對性反映高風(fēng)險(xiǎn)HCP殘留蛋白的實(shí)際存在狀況。
定制化宿主細(xì)胞蛋白殘留檢測試劑盒抗原校準(zhǔn)品更具代表性,減少HCP漏檢和定量誤差。Vero宿主細(xì)胞蛋白(HCP)殘留檢測高風(fēng)險(xiǎn)蛋白
樣品質(zhì)量是影響宿主細(xì)胞蛋白(HCP)殘留檢測結(jié)果的因素之一。HCP 檢測覆蓋生物制品生產(chǎn)全流程,包含收獲、純化、制備等多個(gè)環(huán)節(jié),不同樣品基質(zhì)會導(dǎo)致 HCP 檢測結(jié)果存在明顯差異。以含佐劑的疫苗為例,佐劑會產(chǎn)生干擾,導(dǎo)致成品中難以檢測 HCP,因此通常在吸附工藝前的原液階段開展檢測。此外,樣品的收集、處理及保存方式也對檢測結(jié)果有重要影響。處理方式不當(dāng)可能造成蛋白降解或變性,進(jìn)而影響檢測結(jié)果。比如將歷史批樣品用作內(nèi)部質(zhì)控品時(shí),需結(jié)合其穩(wěn)定性數(shù)據(jù),合理設(shè)定保存條件與保存期限,以此保障檢測方法的準(zhǔn)確性和穩(wěn)定性。
Vero宿主細(xì)胞蛋白(HCP)殘留檢測高風(fēng)險(xiǎn)蛋白抗體覆蓋率是 HCP 檢測關(guān)鍵指標(biāo),影響結(jié)果可信度,需通過方法驗(yàn)證。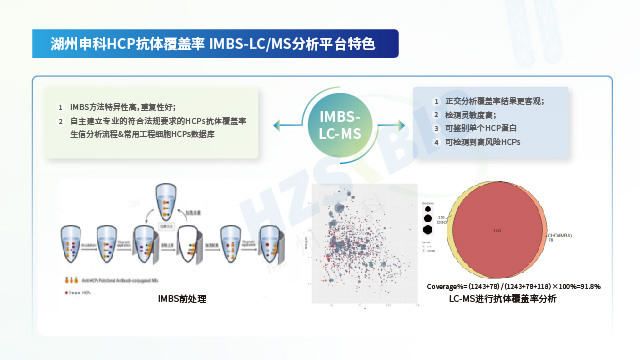
美國藥典 <1132> 與歐洲藥典 < 2.6.34 > 建議,對即將進(jìn)入商業(yè)化生產(chǎn)(臨床 III 期及后續(xù)階段)或生產(chǎn)工藝已穩(wěn)定的生物制品,采用定制化 ELISA 試劑盒開展宿主細(xì)胞蛋白(HCP)殘留檢測,背后原因主要包括四點(diǎn):①確保檢測方法能充分覆蓋實(shí)際工藝產(chǎn)生的 HCPs,防止漏檢關(guān)鍵雜質(zhì);②為更準(zhǔn)確的免疫原性與安全性評估提供支持;③提供真實(shí)的工藝表征數(shù)據(jù),而非推測性數(shù)據(jù);④滿足商業(yè)化生產(chǎn)質(zhì)量控制對方法一致性的要求。此外,研究人員對當(dāng)前市場常見的 HCP ELISA 商業(yè)化試劑盒進(jìn)行測試,并將其與 HCP ELISA 定制化試劑盒對比。實(shí)驗(yàn)結(jié)果顯示,不同商業(yè)化試劑盒檢測同一樣品的數(shù)值差異明顯,且準(zhǔn)確性均低于定制化試劑盒 —— 這一結(jié)果表明,定制化試劑盒更能滿足產(chǎn)品質(zhì)量控制的實(shí)際需求。
依據(jù)美國藥典 1132 章節(jié)規(guī)定,HCPs 校準(zhǔn)品需具備代表性,能夠覆蓋實(shí)際產(chǎn)品生產(chǎn)工藝中的 HCPs。結(jié)合 HCP 免疫檢測方法的使用目的與預(yù)期風(fēng)險(xiǎn)管理需求,為滿足工藝開發(fā)、驗(yàn)證需求,同時(shí)應(yīng)對下游工藝可能出現(xiàn)的異常失效或工藝變更情況,建議選用上游發(fā)酵工藝末端(如澄清處理后的工藝點(diǎn))的樣本作為 HCPs 來源。實(shí)際制備時(shí),可采用空細(xì)胞或空載細(xì)胞,在模擬實(shí)際工藝的預(yù)設(shè)條件下采集樣本,再通過二維電泳、高分辨率質(zhì)譜等蛋白質(zhì)組學(xué)技術(shù),對模擬工藝與實(shí)際工藝下 HCPs 的代表性開展表征分析。越靠近下游工藝,HCPs 的蛋白種類越少,雖更接近成品(DS)中的 HCPs,但這類樣本可能無法滿足工藝開發(fā)與驗(yàn)證需求,也難以覆蓋工藝潛在風(fēng)險(xiǎn),因此通常不推薦使用,或只作為上游工藝 HCPs 免疫檢測方法的輔助材料。
生物制品臨床申報(bào)需提交 HCP 抗體覆蓋率數(shù)據(jù),否則可能面臨監(jiān)管發(fā)補(bǔ)要求。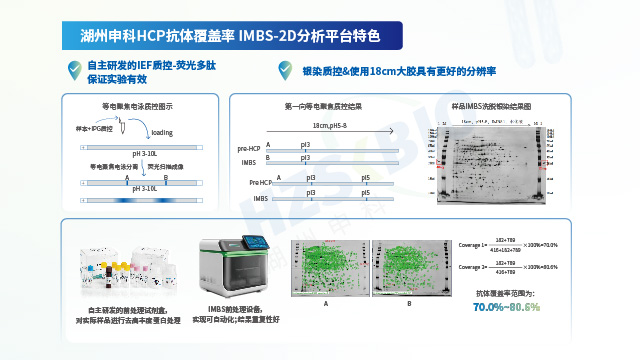
宿主細(xì)胞蛋白殘留檢測中,抗體覆蓋率評估實(shí)驗(yàn)的操作難度較高,需在實(shí)驗(yàn)方法建立階段對關(guān)鍵步驟開展充分驗(yàn)證,以確保實(shí)驗(yàn)方法具備穩(wěn)健性。湖州申科研發(fā)的磁珠捕獲式 IMBS 技術(shù)(immunomagnetic beads separation,免疫磁珠分離),在開發(fā)過程中已對關(guān)鍵步驟進(jìn)行充分驗(yàn)證,相關(guān)驗(yàn)證結(jié)果已通過專業(yè)評審,具體驗(yàn)證內(nèi)容(部分)如下:① 方法優(yōu)化:圍繞磁珠與抗體的偶聯(lián)比例、洗滌液體積、洗滌次數(shù)、洗脫次數(shù)等關(guān)鍵參數(shù)開展優(yōu)化驗(yàn)證,確保方法穩(wěn)健性;② 過程質(zhì)控:二維電泳存在實(shí)驗(yàn)步驟繁瑣、時(shí)間跨度大、中間環(huán)節(jié)難把控等問題,因此在等電聚焦實(shí)驗(yàn)環(huán)節(jié)引入熒光標(biāo)記多肽,可快速判定等電聚焦效果;同時(shí)在 SDS-PAGE 電泳兩側(cè)增設(shè) 40 ng 銀染質(zhì)控樣品,用于控制銀染顯色過程;③ 方法重復(fù)性:針對 2D 分析與 LC-MS 分析開展重復(fù)性驗(yàn)證,其中 2D 分析方法的重復(fù)性可達(dá) 80% 以上,LC-MS 分析方法的重復(fù)性可達(dá) 90% 以上;④ 上樣量優(yōu)化:針對 2D 分析與 LC-MS 分析實(shí)施上樣量驗(yàn)證,規(guī)避上樣量差異對檢測結(jié)果的影響;⑤ 假陽性排查:排查樣品與陰性抗體間是否存在非特異性結(jié)合,確認(rèn) IMBS 實(shí)驗(yàn)設(shè)定的步驟與參數(shù)是否會導(dǎo)致假陽性結(jié)果。
深入分析宿主細(xì)胞蛋白殘留檢測的數(shù)據(jù),能為生產(chǎn)工藝的優(yōu)化調(diào)整提供明確方向。Vero宿主細(xì)胞蛋白(HCP)殘留檢測高風(fēng)險(xiǎn)蛋白樣品與抗體的匹配程度對宿主細(xì)胞蛋白殘留檢測的結(jié)果影響很大。Vero宿主細(xì)胞蛋白(HCP)殘留檢測高風(fēng)險(xiǎn)蛋白
湖州申科運(yùn)用免疫磁珠分離技術(shù)(IMBS),搭配 2D 電泳或 LC-MS 技術(shù)評估抗體覆蓋率。IMBS 的主要流程涵蓋:多克隆抗體與磁珠的偶聯(lián)反應(yīng)、磁珠未結(jié)合位點(diǎn)的封閉處理、HCP 樣本與結(jié)合抗體的磁珠共同孵育反應(yīng)。該過程中,HCP 抗體會結(jié)合可識別的 HCP,未被識別的 HCP 則通過后續(xù)洗滌步驟去除,隨后借助低 pH 等洗脫條件,收集抗體捕獲的 HCP。此方法具備 AAE(抗體親和提取,Antibody Affinity Extraction)免疫層析柱分離的全部優(yōu)勢,同時(shí)免疫磁珠可在懸浮狀態(tài)下與 HCP 樣品充分混勻并結(jié)合,HCP 結(jié)合效果更優(yōu);且依托磁珠吸附,能減少 HCP 與填料的非特異性吸附,進(jìn)一步提升實(shí)驗(yàn)準(zhǔn)確性。
Vero宿主細(xì)胞蛋白(HCP)殘留檢測高風(fēng)險(xiǎn)蛋白
相關(guān)新聞
- 上海內(nèi)毒素檢測常見問題分析 2025-10-31
- 江蘇化學(xué)制藥熱原檢測商業(yè)化試劑盒 2025-10-31
- 上海疫苗熱原檢測規(guī)范 2025-10-31
- 上海疫苗內(nèi)毒素檢測風(fēng)險(xiǎn)評估 2025-10-31
- 合規(guī)性熱原檢測規(guī)范 2025-10-31
- 高效熱原檢測體系 2025-10-31
- 北京細(xì)胞基因治療產(chǎn)品用宿主細(xì)胞蛋白(HCP)殘留檢測抗體制備 2025-10-31
- 北京生物制品宿主細(xì)胞蛋白(HCP)殘留檢測免疫策略 2025-10-31
- 山東熱原檢測操作步驟 2025-10-31
- Vero宿主細(xì)胞蛋白(HCP)殘留檢測高風(fēng)險(xiǎn)蛋白 2025-10-31
推薦新聞
- 吉林自動稱重智能醫(yī)廢管理收集車供應(yīng)商 2025-10-31
- 口服益生元作用 2025-10-31
- 浙江質(zhì)量醫(yī)用吊塔一體化 2025-10-31
- 同濟(jì)生物黃精提取物供應(yīng)報(bào)價(jià) 2025-10-31
- 經(jīng)顱運(yùn)動誘發(fā)電位證書 2025-10-31
- 抑菌涂層案例 2025-10-31
- 西安抗凝血涂層定制 2025-10-31
- 廣東深圳EDTA血常規(guī)真空**管供應(yīng)商 2025-10-31
- 貴州智能壓差滅菌機(jī)24小時(shí)服務(wù) 2025-10-31
- 上海智能易型EMA服務(wù)熱線 2025-10-31